
 КОРЗИНА
КОРЗИНА
Изучение реакций организма на различные искусственные материалы имеет большое значение в связи с созданием эндопротезов в травматологии и ортопедии, восстановительной медицине и стоматологии. Исследования последних лет показали, что ткани биологических систем, в том числе и ткани человеческого организма, обладают специфическими свойствами: способны не разрушаться при значительных деформациях в условиях многократных нагрузок и вибраций и восстанавливать исходную форму после устранения нагрузки, проявляя высокие эластичные свойства. Совместимость живых и неживых тканей предполагает отсутствие перегрузок и макросдвигов на поверхности раздела имплант ‒ ткань организма. В связи с этим достаточно много имплантов изготавливают из металлов, широкое применение которых обусловлено их прочностью, жесткостью, коррозийной и износостойкостью [1].
Требования биомеханической совместимости и фиксации импланта в тканях организма могут быть удовлетворительно решены, если использовать материалы с шероховатой поверхностью, к которой способна прочно прикрепляться живая ткань. При этом создаются два способа связей между имплантом и живой тканью: механическое сцепление в результате образования (прорастания) ткани в порах импланта и химическое соединение за счет взаимодействия ткани с компонентами элементного состава импланта. Вид материала и характер поверхности влияют на реакции, протекающие на границе раздела живая ткань ‒ имплант [1, 2].
В связи с вышеизложенным была определена цель исследования: сравнить изменения тканей после имплантации в кость металлических изделий с шероховатой или гладкой поверхностью.
В проксимальный мыщелок большеберцовой кости 10 беспородных кроликов имплантировали металлические изделия ADiN Touareg (Израиль) – шероховатый дентальный имплант с обработанной поверхностью (пескоструйной обработкой и протравленной кислотой); и 3S (Израиль) – с гладкой полированной поверхностью для бикортикальной дентальной имплантации. Оба изделия уже в течение нескольких лет применяют в клинических условиях.
Все манипуляции с животными не были связаны с причинением им боли и проведены с соблюдением «Правил проведения работ с использованием экспериментальных животных» (Приказ МЗ СССР № 755 от 12 августа 1977 г.; Приказ Министерства высшего и среднего специального образования СССР № 742 от 13 ноября 1984 г.). Имплантацию проводили с соблюдением всех правил асептики и антисептики в условиях чистой операционной под общим наркозом на основе тотальной внутривенной анестезии пропофолом.
Последовательность манипуляций для внедрения имплантов:
Для морфологического кроликов животных выводили из эксперимента через 2 и 6 месяцев после операции передозировкой ингаляционного эфирного наркоза. Для последующего морфологического исследования большеберцовую кость целиком фиксировали в 4 % растворе параформальдегида на фосфатном буфере не менее 1 суток и подвергали декальцинации раствором «Биодек R» (Bio Optica Milano, Италия) в течение 7 суток, который, по сравнению с кислотной декальцинацией, в меньшей степени повреждает ткани. Далее фрагменты кости дегидратировали в этаноле возрастающей концентрации, просветляли в ксилоле и заключали в пластифицированный парафин. Срезы толщиной 5–7 мкм окрашивали гематоксилином и эозином, изучали при увеличении светового микроскопа Axioimager M1 (Zeiss, Германия) до 1200 раз.
На удаленных имплантах ADiN Touareg макро- и микроскопически было обнаружено множество обрывков тканей. Край проксимального мыщелка большеберцовой кости, непосредственно прилегающий к импланту, при микроскопическом исследовании не имел заметных изменений. Можно отметить только наличие структур костной мозоли на некоторых участках. В костном мозге, в местах его контакта с материалом импланта, отмечено формирование тонкой полоски компактной костной ткани (рис. 1, а). Но в некоторых случаях инородное тело было отделено от структур костного мозга волокнистой соединительной тканью, ближе к металлу – плотной, далее – рыхлой. Сам костный мозг, и красный и желтый, видимых патологических изменений не имел. В самой костной ткани, непосредственно примыкающей к инородному телу, и в костном мозге присутствовали различные по размерам фрагменты металла без воспалительной реакции вокруг (рис. 1, б).
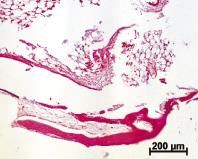
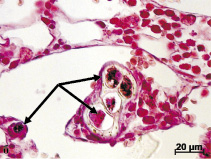
Рис. 1. Результаты внедрения в проксимальный мыщелок большеберцовой кости кроликов металлических винтовых имплантов с шероховатой поверхностью. Окраска гематоксилином и эозином: а – формирование тонкой полоски компактной кости с рубцовыми изменениями в месте контакта костного мозга с материалом инородного тела спустя 2 месяца после имплантации; б – инкапсулированные частицы металла (стрелки) в красном костном мозге спустя 6 месяцев после внедрения импланта.
На изделиях 3S с гладкой поверхностью остатков тканей было значительно меньше. В некоторых случаях непосредственно в ткани мыщелка после внедрения инородного тела на малом увеличении светового микроскопа можно было найти четкие следы от граней винтовой резьбы импланта, края кости имели рубцовые изменения, а полости, образовавшиеся после удаления изделия, были заполнены кровью или фибрином. Следует отметить, что иногда было найдено истончение всей кости на ограниченных участках, что может быть связано с установкой именно в эти места винтовой резьбы (грани наружного диаметра винта) или с длительным давлением инородного тела на костную ткань (рис. 2, а).
В красном и желтом костном мозге, находящемся внутри кости в месте внедрения инородного тела, патологических изменений не было отмечено. По ходу импланта 3S костный мозг отграничивался волокнистой соединительной тканью: ближе к металлу – плотной, дальше – рыхлой или тонкой полоской компактной кости. Иногда в такой соединительной ткани присутствовали геморрагии. В некоторых случаях было практически невозможно различить плотную волокнистую соединительную ткань от грубоволокнистой ткани кости. Возможно, что на некоторых участках эти типы соединительной ткани, разграничивающие инородное тело и структуры костного мозга, переходят друг в друга.
Необходимо также отметить наличие частиц металла в соединительной ткани, отграничивающей костный мозг от поверхности импланта 3S, причем металл присутствовал и рядом с рыхлой соединительной тканью и рядом с грубоволокнистой, сходной с костью. Но число таких металлических фрагментов и их размеры были значительно меньше, чем после внедрения изделия с шероховатой поверхностью (рис. 2, б).
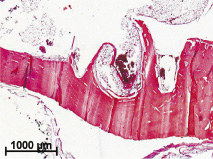
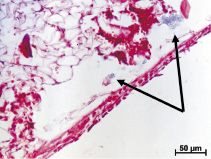
Рис. 2. Результаты имплантации в костную ткань кроликов винтовых имплантов из гладкого полированного металла: а – в костной ткани через 6 месяцев после внедрения импланта присутствуют следы от граней его винтовой резьбы. Полости, образовавшиеся после извлечения инородного тела, заполнены фибрином или форменными элементами крови. Окраска гематоксилином и эозином; б – плотная волокнистая соединительная ткань с геморрагиями и частицы металла (стрелки) в костном мозге в области инородного тела спустя 2 месяца после хирургического вмешательства. Окраска гематоксилином и эозином.
Из-за шероховатой поверхности имплантов ADiN Touareg к ним прочно присоединяются окружающие ткани, врастают в поры, и при выкручивании таких изделий происходит значительная травматизация тканей вокруг места имплантации. Гладкие полированные импланты 3S имеют меньшую площадь контакта с тканями организма, они фиксируются за счет бикортикальной имплантации, при удалении легко выкручиваются и не разрывают окружающие ткани. В связи с этим на удаленных имплантах ADiN Touareg присутствовало множество обрывков тканей, а на изделиях 3S с гладкой поверхностью тканевых фрагментов практически не было.
Уменьшение толщины кости на ограниченных участках в месте контакта с гранями резьбы имплантов, наиболее вероятно, обусловлено сначала атрофическими процессами, а затем – реорганизацией костной ткани. В литературе имеются многочисленные сообщения об атрофических и даже некротических изменениях тканей, контактирующих с инородными телами [2, 6, 8, 9].
Любое инородное тело отграничивается от организма соединительнотканной капсулой и это является нормальной тканевой реакцией [3–5]. Наиболее вероятно, что вследствие именно этого произошло обнаруженное отграничение имплантов от структур костного мозга различными типами волокнистой соединительной ткани: ближе к металлу – плотной, дальше – рыхлой. Иногда там формировалась даже тонкая полоска компактной кости, которая также является одним из типов соединительной ткани. Возможно, что на некоторых участках эти типы соединительной ткани, разграничивающие инородное тело и структуры костного мозга, переходят друг в друга.
В месте контакта живых тканей с имплантом происходит реакция тканей организма на инородное тело. По-видимому, импланты сразу после внедрения в кость сначала инициируют острую воспалительную реакцию вследствие операционной травмы и непосредственного взаимодействия живых тканей с твердым неэластичным неживым веществом. Постепенно острый воспалительный процесс сменяется хроническим, и по мере его затухания происходит полное сращение поверхности имплантов с костью.
При удалении изделия такие плотные соединения костной ткани с металлом разрываются и вследствие этого полости в кости (следы от граней винтовой резьбы импланта) заполняются кровью или фибрином. Из-за этой же причины присутствовали геморрагии в соединительной ткани, отграничивающей инородное тело от костного мозга.
Кроме того, так как даже прочные инородные тела разрушаются системами защиты организма, именно по границе импланта происходят процессы его деградации. Большие и малые фрагменты любых инородных тел «отрезаются» фагоцитами [3–5, 7], обволакиваются соединительной тканью, поглощаются макрофагами (гигантскими клетками инородных тел), содержащими среди прочих лизосомальных фрагментов металлопротеиназы, и транспортируются в другие органы для элиминации. С этим связано присутствие в тканях вокруг имплантов их мелких частиц. Закономерно, что частицы поверхности шероховатых изделий легче фрагментируются и отделяются от инородного тела [5].
То есть чем инертнее для организма материал импланта, тем менее выраженной на него будет реакция макрофагальной системы (и наоборот). Следовательно, отсутствие воспалительной реакции, гигантских клеток инородных тел, соединительнотканной капсулы в окружающих тканях на все сроки исследования свидетельствуют об инертности материала изделий ADiN Touareg и 3S для живого организма, о совместимости их материалов с тканями.
Работа выполнена при поддержке и техническом обеспечении Международного центра имплантологии «iDent» (г. Новосибирск).
Таким образом, во всех случаях импланты ADiN Touareg (с шероховатой поверхностью) и 3S (гладкий полированный) плотно прилегали к костной ткани проксимального мыщелка большеберцовой кости, края которого имели незначительные рубцовые изменения. В структурах костного мозга инородные тела отграничивались от организма различными типами соединительной ткани. Признаки воспаления и формирования слившихся многоядерных макрофагов не были найдены ни в одном случае, что свидетельствует об инертности материала указанных изделий для живого организма, о высокой совместимости подобных материалов с биологическими тканями. Однако в некоторых наблюдениях, и при имплантации шероховатого ADiN Touareg, и при внедрении полированных 3S, в тканях были обнаружены частицы металла, но после использования ADiN Touareg металл встречался чаще, а его фрагменты были большего объема. Существенные гистологические различия костной ткани после внедрения имплантов с шероховатой и полированной поверхностью отсутствуют. Также нет выраженных отличий между состоянием окружающих тканей через 2 и 6 месяцев после внедрения каждого изделия.
